طريقة تجديد مركب الطاقة ATP
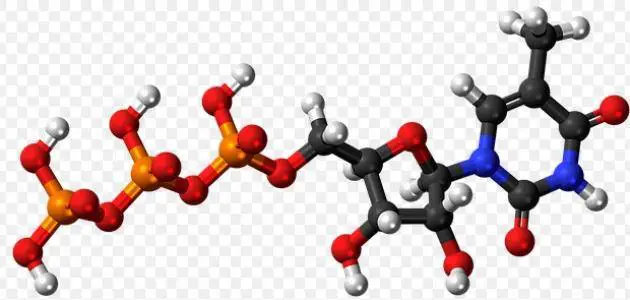
طريقة تجديد مركب الطاقة ATP، يعتبر مركب الطاقة ATP من النوع Adenosine TriPhosphat وهو أدينوسين يحتوي على ثلاث مجموعات من الفوسفات حيث يتم اختزان مستويات الطاقة بداخله في النيوكليوتيدات وهي تتشكل بداخله على هيئة روابط توجد بين مجموعة الفوسفات.
مركب الطاقة ATP
- يعتبر مركب الطاقة الذي يوجد في الخلية واحد من أهم الجزيئات التي تقوم بالانتشار في جميع الكائنات الحية بلا استثناء حيث يتكون من سكر يسمى سكر الريبوز وهو عبارة عن سكر خماسي الجزيئات يحتوي على 5 ذرات كربون متحدة معًا.
- ويتكون أيضًا من قاعدة نيتروجينية والتي تسمى بالأدنين بالإضافة إلى ثلاث مجموعات من عنصر الفوسفات.
- يمكننا أن نحصل على مركب من ATP عن طريق أتحاد مركب ADP أو ما يسمى أدينوسين ذات مجموعة فوسفات ثنائية بالإضافة إلى تواجد مجموعات من الفوسفات ذات الطاقة العالية.
- أما عن الصيغة الكيميائية الخاصة بالمركب فهي C10H16N5O13P3 حيث يوجد داخل مركب الطاقة كتلة من المول تقدر 507.18 جم/مول.
تفاعلات تخليق البروتين
- يمكن إجراء تفاعلات تخليق البروتين الخالية من الخلايا بطرق متنوعة، مثل استخراج من مصادر خلايا مختلفة مع اختلافات في تركيزات الملح أو الأحماض الأمينية.
- إضافة عوامل مساعدة أو مثبطات محددة مع تكوينات المفاعل المختلفة التي تم استخدامها كلها، فإن أحد المتطلبات الشائعة لجميع التفاعلات الخالية من الخلايا هو توفير ATP لدفع الترجمة أو الجمع بين عمليات النسخ والترجمة.
- عادة ما يتم توليد إمدادات ATP من مصدر طاقة ثانوي يضاف إلى التفاعل تقليديا عن طريق مركب يحتوي على رابطة فوسفات عالية الطاقة مثل فوسفوينول بيروفات أو فوسفات الكرياتين او استيل فوسفات.
- يتم إضافة ذلك إلى التفاعل لتجديد ATP في تفاعل فسفرة بسيط على مستوى الركيزة.
- ومع ذلك فإن هذه المركبات باهظة الثمن ويمكن أن تخلق مستويات مثبطة للفوسفات غير العضوي في التفاعل.
- تم القيام بالكثير من العمل في السنوات الأخيرة الأخير لتنشيط عملية التمثيل الغذائي المعقدة التي يمكن أن تحدث أثناء تخليق البروتين الخالي من الخلايا.
- بمعرفة أكثر تقدمًا والتحكم في عملية التمثيل الغذائي الخلوي، لم يعد علينا الاعتماد على تفاعلات الفسفرة ذات الخطوة الواحدة لدفع تخليق البروتين الخالي من الخلايا.
- أثبتت تفاعلات متعددة الخطوات أو مسارات كاملة لتوليد الطاقة، مثل تحلل السكر و الفسفرة التأكسدية، أنها نشطة في التفاعلات الخالية من الخلايا.
- توفر أنظمة الطاقة ATP من مصادر طاقة أقل تكلفة أثناء إطالة تفاعل تخليق البروتين.
استخدام مركب ATP في الأدوية
- 30 ٪ تقريبًا من مستوى ATP يتواجد داخل الخلايا حيث تم العثور على زيادة التعرض للإجهاد التأكسدي في خلايا RPE من المتبرعين المسنين.
- تشير هذه النتائج إلى وجود صلة بين حالة الطاقة للخلية وحساسية الإجهاد التأكسدي وضعف وظيفةRPE.
- أوضحت هذه الدراسات أنه هناك مقارنة لخلايا RPE بين الأفراد في مختلف الأعمار حيث من الصعب فرز الآليات الفردية.
- هناك صلة بين مستويات ATP داخل الخلايا المنخفضة بشكل معتدل، واستجابة للإجهاد و البلعمة الذاتية كآلية إصلاح رئيسية للإصابة المرتبطة بالعمر، ووظيفة RPE البلعمية العادية.
- تم علاج خلايا RPE من فرد يبلغ من العمر 38 عامًا بتركيز من atractyloside وهو مثبط لإمداد ATP التي توجد في الميتوكوندريا مما يؤدي إلى انخفاض في مستويات ATP داخل الخلايا مقارنة بما يشاهد في RPE المسن.
- أما في حالة الظروف الهوائية، تُظهر خلايا RPE البشرية التي تكون مستزرعة مستويات عالية من إنتاج اللاكتات.
- تم الاكتشاف أن شبكية العين سليمة وبالتالي، قد تكون الخلايا المستزرعة قادرة على الأقل جزئيًا على تعويض الانخفاض الناجم عن Atractyloside من إمدادات ATP في الميتوكوندريا عن طريق زيادة إنتاج ATP غير الميتوكوندريا.
- بالنظر إلى أن توليف ATP من حيث إنتاج اللاكتات فهو أقل فاعلية بكثير من إنتاج ATP في الميتوكوندريا فإن التعويض يكون نادرًا.
- غير المعروف إلى أي مدى يمكن موازنة الانخفاض المرتبط بالعمر في إنتاج طاقة الميتوكوندريا عز طريق إنتاج اللاكتات في الجسم الحي.
- أدى استخدام تركيز معتدل من أتراك تيلوسيد الى تقليل التكاثر لمستويات ATP في خلايا RPE بنسبة 30٪ تقريبًا مثل الظروف التي لوحظت في عمر RPE.
- وهكذا، يبتكر هذا العلاج بالأتراكتيلوسيد نموذجًا مناسبًا لدراسة آثار نقص الطاقة المعتدل على الوظائف والهياكل الخلوية.
تأثير نقص ATP داخل الخلايا
- أن خفض مستوى ATP داخل الخلايا يقلل من قدرات خلايا RPE على التعامل مع الإجهاد التأكسدي، كما أن انخفاض مستوى الجلوتاثيون المنخفض هو مؤشر حساس لخطر الضرر التأكسدي.
- في حين أن الإجهاد التأكسدي المستحث بواسطة tBH لم يؤثر على انخفاض الجلوتاثيون داخل الخلايا في خلايا RPE مع مستويات ATP العادية
- فقد تسبب الانخفاض بنسبة 30 ٪ في ATP في انخفاض الجلوتاثيون المنخفض الناجم عن tBH إلى جانب انخفاض أنشطة الإنزيمات المضادة للأكسدة لدى المسنين RPE.
- كما أن الارتباط المباشر بين انخفاض مستويات ATP وتقليل آليات الدفاع غير الأنزيمية ضد الجذور الحرة قد يعزز الضرر التأكسدي.
- من بين الأهداف الخلوية العديدة الإجهاد التأكسدي، فإن الدهون هي الفئة الأكثر مشاركة من الجزيئات الحيوية.
الأضرار الناتجة عن نقص ATP الخلوي
- في أكسدة الأحماض الدهنية المتعددة غير المشبعة، التي تسمى بيروكسيد الدهون تؤدي إلى تواجد عدد من المنتجات الثانوية السامة بشكل رئيسي في الألدهيدات الكهربية المتفاعلة والتي قد تسبب تلفًا خلويًا شديدًا.
- MDA هو أحد الأمثلة الأكثر دراسة على هذه الألدهيدات المشتقة من بيروكسيد الدهون السامة وهي علامة حساسة الإجهاد التأكسدي وأكسدة الدهون.
- 29 MDA هو جزيء عالي السمية يعتبر متورطًا في التسبب في تدهور RPE في اضطرابات الشبكية.
- ترتبط التأثيرات السامة لـ MDA ومنتجات بيروكسيد الدهون ذات الصلة حيث لها القدرة على تكوين مقويات البروتين والصلات المتشابكة بالإضافة إلى خصائصها المطفرة.
- فإن الكشف عن مقويات بروتين MDA هو مقياس حساس للضرر الناجم عن البيروكسيد.
- لقد تمت بعض الأبحاث على إحداث الإجهاد التأكسدي بواسطة tBH وأرتبط الانخفاض المعتدل بالفعل في ATP الخلوي بزيادة تكوين إضافة MDA على البروتينات الخلوية.
- من المعروف أن بيروكسيد الدهون يولد بعض الأشياء التي تكون بشكل محدد على البروتينات الخلوية التي تستهدف تفاعلات المناعة الخلوية والخلطية.
- 33 ARMD هو مرض معقد ناتج عن مزيج من العوامل البيئية والاستعداد الوراثي.
- من بين الجينات المتنوعة المتورطة في ARMD تم العثور على العديد من الجينات المناعية الالتهابية المختلفة.
- ضعف الميتوكوندريا والضرر التأكسدي للبروتين يمكن أن يساهم في التسبب في الضمور البقعي.
الحمض النووي
- يعد الحمض النووي من بين الأهداف الأكثر أهمية بيولوجيًا الضرر التأكسدي، ويعتقد على نطاق واسع أن الضرر التأكسدي المستمر للحمض النووي يساهم بشكل كبير في الاضطرابات المرتبطة بالعمر.
- تكوين 8-هيدروكسي ديوكسي غوانوزين (8-OhdG) هو علامة حساسة للإجهاد التأكسدي الناتج عن تلف الحمض النووي.
- تشير بعض النتائج إلى وجود صلة بين انخفاض مستويات ATP وطفرات DNA بالتحديد حيث قد يكون عدم استقرار الجينوم الميتوكوندريا بسبب قابلية mtDNA للإجهاد التأكسدي وفشل حماية mtDNA وإصلاحه عوامل مهمة في تنكس الشبكية.
- على الرغم من أنه تم وصف علاج أتراك لوسيد لزيادة إنتاج الجذور الحرة للميتوكوندريا.
- لم يلاحظ أي زيادة في تكوين بروتين MDA أو توليد 8OhdG وهذا يشير إلى أن الزيادة في الضرر الناتج عن الإجهاد التأكسدي بعد العلاج المركب atractyloside/ tBH.
- وبدلاً من ذلك يبدو أن فقد الطاقة الناتج عن الأتراك لوسيد يسبب تلف tBH عن طريق إضعاف حماية الخلايا من الإجهاد على سبيل المثال عن طريق خفض مستويات الجلوتاثيون المنخفض.
توليف الجلوتاثيون
- توليف الجلوتاثيون هو عملية تعتمد بشكل كبير على ATP وقد ثبت أن انخفاض ATP نتيجة لنقص الأكسدة يضعف التخليق الحيوي للجلوتاثيون في خلايا الكبد.
- في دراسة أخرى أوضحت أنه يرتبط انخفاض ATP الخلوي بتدفق منخفض من الخلايا GSH.
- لاحظ الباحثون أيضًا انخفاضًا طفيفًا في إجمالي الجلوتاثيون بحوالي 10٪ لكن هذا التأثير كان صغيرًا جدًا بحيث لا يفسر تمامًا الانخفاض المدهش في انخفاض الجلوتاثيون في الدراسات التي أجريت.
مستويات ATP والأكسدة والاختزال
- تشير بعض المعلومات إلى وجود صلة مباشرة بين مستويات ATP الخلوية وحالة الأكسدة والاختزال في خلايا RPE.
- قد تتأثر إمدادات NADPH للحد من الجلوتاثيون عبر مسار فوسفات البنتوز أو تفاعل اختزال الجلوتاثيون.
- على الرغم من أن الأسباب الجزيئية الدقيقة لا تزال قائمة، إلا أن بعض النتائج أثبتت أنه هناك علاقة سببية بين انخفاض إمدادات الطاقة داخل الخلايا وضعف البروتينات الخلوية والحمض النووي للضغط التأكسدي الناتج عن الضرر في RPE البشري.
- ثبت أن تثبيط البلعمة الذاتية يسبب تغيرات سلبية في أنسجة الثدييات تشبه تلك المرتبطة بالشيخوخة، وكثيرا ما ترتبط الشيخوخة الطبيعية والمرضية بانخفاض قدرة البلعمة الذاتية.
- الالتهام الذاتي هو الآلية الرئيسية التي يمكن من خلالها تجديد جميع الأجزاء السيتوبلازمية للخلايا ما بعد الانقسام لذلك تعتبر عملية حيوية تمنع تراكم الجزيئات الحيوية والهياكل الخلوية التالفة.
- 41 ينطبق هذا أيضًا على الإجهاد التأكسدي.
- إذا فشلت أنظمة الإنزيمات المضادة للأكسدة ومضادات الأكسدة الخلوية في منع الضرر التأكسدي، فإن الالتهام الذاتي يصبح ساريًا كخط حماية ثانٍ من خلال تحطيم الهياكل الخلوية المتضررة تأكسديًا.
- وبناءً على ذلك، فقد ثبت أن الإجهاد التأكسدي ومنتجات بيروكسيد الدهون تعمل على تنظيم البلعمة الذاتية لمنع تراكم الضرر.
- ومع ذلك، فإن البلعمة الذاتية هي عملية تستهلك الكثير من الطاقة وقد تتأثر بنقص
تأثير انخفاض مستويات ATP
- تشير النتائج التي تم الحصول عليها أن مستويات ATP منخفضة بالفعل قد تؤثر على البلعمة الذاتية في خلايا RPE، وبالتالي تضعف استجابة الضغط، فإن التأثير يتوقف على البلعمة الكلية الكلاسيكية.
- يمثل الفرق بين إجمالي معدلات تحلل البروتينات الليزوزومية حساسة للأمونيا والبلعمة الكلية الحساسة لميثيللادينين مساهمة لمسارات البلعمة الذاتية البديلة، بما في ذلك البلعمة الذاتية التي تتم بواسطة البلعمة الدقيقة.
- لم يتأثر هذا الاختلاف بعجز الطاقة الذي عن أتراكتيلوسيد البلعمة حيث تدهور الجزء الخارجي من المستقبلات الضوئية فهي وظيفة صيانة حيوية يؤديها RPE للحفاظ على نشاط التحويل الضوئي وقابلية المستقبلات الضوئية.
- نظرًا لأنها عملية تستهلك طاقة هائلة، فقد تم ربط تثبيط توليد الميتوكوندريا ATP بالفعل بقدرات تحلل بالعاميه منخفضة لخلايا RPE.
- تشير بعض من النتائج المختبرية التي تمت، إلى أن المستويات المنخفضة بشكل معتدل من ATP قد تساهم في ضعف خلايا RPE في تلف الإجهاد التأكسدي والخلل الوظيفي.
- وقد لوحظ هذا على مستويات ATP التي تحدث أيضًا في الجسم الحي في RPE للأفراد المسنين.
- لذلك، يجب أن تتناول الدراسات المستقبلية في الجسم الحي صلة محتملة بين انخفاض إنتاج ATP في العمر RPE واضطرابات العين التنكسية المرتبطة بالعمر.
إعادة إنشاء مسارات كاملة لتوليد الطاقة
- القدرة على تنشيط تفاعلات متعددة الخطوات من خلال إضافة عوامل مساعدة أو إنزيمات تمكن من إعادة إنشاء مسارات توليد الطاقة بأكملها في تفاعلات خالية من الخلايا.
- لفترة طويلة، لم يتم تحديد الأنشطة الأيضية المحفزة بمستخلص الخلايا الخام بشكل جيد ومع ذلك أصبح من الممكن الآن تنشيط المسارات الأيضية المعقدة لتوليد نيوكليوتيد ثلاثي الفوسفات.
- من المفترض أن تكرار الظروف الملائمة داخل الخلايا سيؤدي إلى تنشيط الوظائف المعقدة داخل الخلايا مما أدى هذا المفهوم إلى تطوير نظام يوميا.
- تتضمن بعض التغييرات المحددة استبدال PEG وهو مركب ذو وزن جزيئي مرتفع يستخدم لثبات الحمض النووي، مع بوليامين أمين بوتريسين وسبيرميدين.
- بالإضافة إلى ذلك، استبدل مصدر طاقة غير الفسفوريل PEP وبالتالي تجنب تراكم الفوسفات أثناء مسار التفاعل.
- يحافظ هذا التفاعل الجديد على توازن درجة الحموضة، بحيث يمكن إزالة المخزن المؤقت بالإضافة إلى ذلك، تم استبدال أملاح الأسيتات بأملاح الجلوتامات معًا.
- أدت هذه التغييرات إلى إنتاج بروتين مماثل لتفاعلات PANOxSP، باستثناء مصدر طاقة أقل تكلفة بكثير.
- ومن المثير للاهتمام أن كمية البروتين العالية أعلى بكثير مما كان متوقعًا من خلال جيل ATP عن طريق تحويل البيروفات إلى أسيتات بمفردها وبالتالي هناك مسار آخر لتوليد الطاقة على حيث تكون الفسفرة التأكسدية مسؤولة عن الطاقة الإضافية.
طرق تجديد مركب الطاقة ATP
- يمكنك أن تجدد مستويات الطاقة الخاصة التي تتواجد في جميع مستويات الخلية عن طريق طرقه متعددة ومختلفة حيث تتواجد بعض الطرق التي تتم بشكل بطيء وطرق تتم بسرعة متوسطة وطرق تتم بشكل سريع للغاية.
تجديد مركب الطاقة ATP عن طريق التّنفس اللاهوائي
- يمكن تعريف عملية التّنفس اللاهوائي أو التنفس الغير طبيعي أنها طريقة تقوم بها بعض من الكائنات الحية عند عدم توافر كمية من الأكسجين.
- تتم في هذه العملية أنه يتم تحويل جزء من الجلوكوز إلى حمض البيروفيك، وذلك في حالة تعرضه للإنزيمات التي تكون متواجدة داخل السيتوبلازم.
- يتم في هذه العملية أو في هذه الطريقة تحويل جزء من مركب ADP يتم تحويله إلى ATP أي يتم التحويل من مركب طاقة إلى مركب آخر وذلك بسبب انطلاق كمية طاقة كبيرة ناتجة من تكسير جزيئات الجلوكوز.
عملية البناء الضوئي ودورها في تجديد ATP
- تلجأ بعض النباتات إلى عملية البناء الضوئي وذلك في حالة عدم توافر الغذاء حيث تقوم بتلك العملية للحصول على الغذاء، حيث تقوم بإنتاج مركب الطاقة ATP كنتيجة إضافية للتفاعل.
- يمكن تقسيم عملية البناء الضوئي إلى عدة مراحل حيث يتم بداخلها عملية تحويل ذرات الكربون إلى جزيئات من الجلوكوز والتي منها حلقة كربس وحلقة كالفن وسلاسل نقل وتحويل الإلكترونات.
- يتم في هذه العمليات إنتاج مركب الطاقة ATP بطريقة مباشرة أو بطريقة غير مباشرة، حيث تقوم بإنتاج مركبات مثل NADH,FADH2 التي تقوم بإنتاج ATP وذلك في حالة دخولها مجموعات وسلاسل نقل الإلكترونات.
الارتباط بالبروتينات ودورها الفعال في تجديد مركب ATP
- تعتبر عملية الارتباط بالبروتينات عملية هامة للغاية ضمن عمليات تجديد مركب الطاقة ATP.
- تكون بداية عملية الارتباط بالبروتينات عند فقدان ذرة هيدروجين إلكترونًا واحدًا حيث تنتقل وتتحول من أيون مستقر إلى أيون غير مستقر.
- عندما تمر ذرات الهيدروجين بواسطة البروتينات الكروية التي تعتبر المكون الرئيسي لمركب ATP يقوم إنزيم ATP باستخدام كمية الطاقة التي تنتج عن طريق حركة ذرات الهيدروجين وذلك أثناء عملية تحويل مركب ADP إلى ATP.
تجديد مركب الطاقة عن طريق العمليات الكيميائيّة
- في حالة احتياج لمركب الطاقة ATP يمكنه التواجد بسهولة حيث أنه يتحرك بسرعات عالية كما يتم توفير كميات هائلة من الطاقة التي تحتاجها الخلية.
- يمكن تعويض مركب الطاقة ATP الذي تم استخدامه في التفاعلات الكيميائيّة التي تتم بشكل بطيء ومن هذه العمليات مثل عملية تحلل السكر والبروتين وأيضًا الدهون التي تقوم بمنح كميات طاقة يتم استخدامها في عملية إنتاج مركب الطاقة ATP.
- من أهم استخدامات ATP في الخلية هو قيامها بتنشيط الرايبوسومات التي تقوم بإنتاج البروتينات وتساعد على توفير كميات الطاقة الهامة للغاية والتي تستخدم في حالة التّقلص العضلي وأيضًا في عملية نقل عنصر الصّوديوم.
ذكرنا لكم في مقالة اليوم طرق تجديد مركب الطاقة ATP مع شرح كل طريقة من طرق التجديد، كما ذكرنا لكم أيضًا بعض المعلومات الهامة والضرورية التي يجب معرفتها عن مستوى الطاقة ATP.